eISSN 2444-7986
DOI: https://doi.org/10.14201/orl.25215
ARTÍCULO DE REVISIÓN
TÉCNICAS DIAGNÓSTICAS DE MEDICINA NUCLEAR EN PATOLOGÍA TIROIDEA: RELACIÓN CON LOS GRUPOS TIRADS Y CITOLOGÍA BETHESDA
Diagnostic procedures of Nuclear Medicine in thyroid pathology: relationship with TI-RADS groups and Bethesda cytology
Esther MARTÍN-GÓMEZ; Paloma GARCIA-TALAVERA; Luis Gonzaga DÍAZ-GONZÁLEZ; Enrique MARTÍN-GÓMEZ; Sara LÓPEZ- PUCHE; Pilar TAMAYO-ALONSO
Hospital Universitario de Salamanca. Servicio de Medicina Nuclear. Salamanca. España
Correspondencia: esthermarg@hotmail.com
Fecha de recepción: 3 de diciembre de 2020
Fecha de aceptación: 21 de diciembre de 2020
Fecha de publicación: 23 de diciembre de 2020
Fecha de publicación del fascículo: 1 de diciembre de 2021
Conflicto de intereses: Los autores declaran no tener conflictos de intereses
Imágenes: Los autores declaran haber obtenido las imágenes con el permiso de los pacientes
Política de derechos y autoarchivo: se permite el autoarchivo de la versión post-print (SHERPA/RoMEO)
Licencia CC BY-NC-ND. Licencia Creative Commons Atribución-NoComercial-SinDerivar 4.0 Internacional
Universidad de Salamanca. Su comercialización está sujeta al permiso del editor
RESUMEN: Introducción y objetivo: La medicina Nuclear, desde sus inicios, ha tenido un papel importante en el estudio y tratamiento de la patología tiroidea. El hallazgo de un nódulo tiroideo es una situación muy frecuente en la práctica clínica diaria. En la actualidad, el desarrollo de nuevas técnicas como son la ecografía de alta resolución y la punción por aspiración con aguja fina ha originado un importante avance en el diagnóstico y manejo de ésta patología. Estos procedimientos han facilitado el desarrollo de sistemas de clasificación según las características ecográficas de los nódulos (TI-RADS) y según sus características citológicas (Bethesda) que orientan sobre la actitud a seguir en los diferentes casos. EL objetivo de este trabajo es realizar una revisión de las indicaciones y recomendaciones de la gammagrafía tiroidea y establecer su relación con los grupos TI-RADS y la citología Bethesda. Síntesis: Debido a que el iodo juega un rol importante en la fisiología y fisiopatología de la glándula tiroides, los radiofármacos del iodo o sus análogos son muy adecuados para el estudio de imágenes tiroideas. A pesar del desarrollo de nuevas técnicas muy precisas para el estudio del nódulo tiroideo, la gammagrafía de tiroides sigue siendo la única técnica capaz de correlacionar anatomía y función tiroidea y, por tanto, es el único examen capaz de demostrar la presencia de nódulos tiroideos autónomos, que raramente conllevan malignidad. Además, imágenes con trazadores específicos como el sestamibi-99mTc y 18F-fluorodeoxyglucosa pueden suministrar información del comportamiento biológico de nódulos citológicamente indeterminados. Conclusión: La gammagrafía de tiroides es el único método diagnóstico que proporciona información del estado funcional de la glándula. Su integración en los grupos TIRADS y Bethesda es de suma importancia para evitar biopsias innecesarias. Además, el uso de radiofármacos específicos, incluyendo la tomografía por emisión de positrones, proporcionan una información útil en el caso de nódulos citológicamente indeterminados.
PALABRAS CLAVE: gammagrafía de tiroides; radiofármacos; NIS; nódulo tiroideo; TI-RADS; bethesda
SUMMARY: Introduction and objectives: Since its beginning, nuclear medicine has played an important role in the study and treatment of thyroid pathology. The finding of a thyroid nodule is a very frequent situation in daily clinical practice. Today, the development of new techniques including high-resolution ultrasound and fine-needle aspiration puncture has led to an important progress in diagnosis and management of the disease. These procedures have enabled the development of classification systems that allow to categorize the nodules by its ultrasound characteristics (TI-RADS) and its cytological characteristics (Bethesda), providing guidance on the attitude to follow in each case. The aim of this work is to conduct a review of the guidelines and recommendations for thyroid scintigraphy as well as to establish its relationship with the TI-RADS groups and the Bethesda cytology. Synthesis: Because iodine plays an important role in the physiology and pathophysiology of the thyroid gland, iodine radiopharmaceuticals or its analogues are very suitable for the study of thyroid imaging. Despite the development of new and very precise techniques for the study of the thyroid nodule, thyroid scintigraphy remains the only technique capable of correlating thyroid anatomy and thyroid function and, therefore, it is the only test capable of demonstrating the presence of autonomous thyroid nodules, which rarely result in malignancy. Furthermore, images with specific tracers such as sestamibi-99mTc and 18F-fluorodeoxyglucose can provide information on the biological behavior of cytologically indeterminate nodules. Conclusion: Thyroid scintigraphy is the only diagnostic method that provides information on the functional state of the gland. Its integration into the TIRADS and Bethesda groups is of the utmost importance to avoid unnecessary biopsies. In addition, the use of specific radiopharmaceuticals, including positron emission tomography, provides useful information in the case of nodules cytologically indeterminate.
KEYWORDS: thyroid scintigraphy; radiopharmaceuticals; NIS; thyroid nodule; TI-RADS; bethesda
INTRODUCCIÓN
El tiroides es una glándula de secreción interna situada en la cara anterior del cuello, justo por debajo del cartílago cricoides, delante de los primeros anillos de la tráquea. Consta de dos lóbulos unidos entre sí por el istmo.
Desde el punto de vista histológico, el tejido tiroideo está formado por un gran número de folículos cerrados, revestidos por células epiteliales cúbicas denominadas tirocitos. Estos folículos contienen en su interior una sustancia secretora denominada coloide. El principal constituyente del coloide es una glucoproteína, la tiroglobulina, cuya molécula contiene las hormonas tiroideas [1].
El tejido tiroideo normal se caracteriza por la capacidad única de sus células foliculares para atrapar y procesar el yodo (I2) que posteriormente se incorpora a la tiroglobulina (Tg) para la formación de las hormonas tiroideas: la tiroxina (T4), que corresponde al 93% de hormona secretada por la glándula tiroides, y la triyodotironina (T3) [2].
El primer paso en la formación de hormonas tiroideas consiste en el trasporte de los yoduros desde la sangre hasta las células y folículos tiroideos. La absorción de yodo por las células foliculares es un proceso activo que depende de la existencia de un gradiente de sodio a través de la membrana basal de la célula tiroidea, de modo que el transporte de dos iones de sodio provoca la entrada de un átomo de yodo contra un gradiente electroquímico. La energía para el transporte del yoduro en contra de un gradiente de concentración proviene de la bomba de sodio-potasio ATPasa, Este proceso, denominado «atrapamiento del yodo», es ejecutado por el simportador de yoduro de sodio (NIS), una proteína transmembrana ubicada en la membrana basolateral de las células foliculares de la tiroides. En condiciones fisiológicas, la expresión y actividad del NIS está regulada por la tirotropina (TSH) [1, 2].
Debido a la íntima relación de la glándula tiroides con el metabolismo del Iodo, la medicina nuclear desde sus inicios ha ocupado un papel importante en el estudio de la patología tiroidea [3].
La utilización del Iodo radiactivo para la exploración funcional del tiroides ha sido una de las primeras aplicaciones en el campo de la Medicina Nuclear. Así, en 1938 Hertz, Roberts y Evans, realizaron estudios sobre la fisiología de la glándula tiroides con I131 y Hamilton y Soley determinan la curva de captación del I131 por el tiroides [4]. Estos mismos autores, en 1940 realizan estudios diagnósticos de las tiroidopatías, utilizando el I131 producido en ciclotrón [3, 4].
Actualmente, el I131 ha sido sustituido en el campo del diagnóstico de las enfermedades tiroideas por el I123 y el pertecnetato-99mTc (un radiofármaco análogo del Iodo que también es trasportado por el NIS), los cuales presentan unas características más idóneas para su utilización en la práctica diaria [2, 3].
RADIOFÁRMACOS
La glándula tiroides atrapa el iodo con un gradiente de concentración superior a 20:1 con respecto al plasma. Por este motivo se comenzó a utilizar el 131I para el diagnóstico y tratamiento de las enfermedades tiroideas. Sus características hacen del I131 el radiofármaco ideal para el tratamiento de la patología tiroidea. Sin embargo, debido a su pobre porcentaje de emisión de fotones gamma y alta radiación ha sido sustituido por otros radiofármacos en la práctica clínica diaria en el campo del diagnóstico [2, 3].
El I123 es el radiofármaco ideal para evaluar la función del NIS y la organificación del Iodo para la formación de las hormonas tiroideas debido a que su emisión gamma (159KeV) proporciona una imagen de buena calidad. No obstante, debido a que se produce en ciclotrón, tiene escasa disponibilidad y es caro.
El pertecnectato 99mTC (99mTcO4-) es un imitador farmacológico del Iodo que se concentra en las células tiroideas por acción del NIS. Es el trazador más utilizado para la realización de los estudios tiroideos en la práctica diaria de un servicio de medicina nuclear. Esto es debido a sus excelentes propiedades: disponibilidad diaria, emisor gamma puro, vida media corta (6 horas) y baja radiación. Sin embargo, solamente refleja la capacidad de atrapamiento por el tiroides, pero no es capaz de metabolizarlo por lo que desaparece pronto de la glándula. Por esta razón, las imágenes hay que adquirirlas dentro de los primeros 30 minutos después de la administración del radiofármaco [2].
Los radiofármacos dirigidos al NIS, por tanto, son idóneos para la realización de imágenes tiroideas ya que facilitan la detección y la localización de anomalías focales o difusas de las células tiroideas, La correlación de anatomía con función y la detección de tejido tiroideo ectópico, tejido metastásico funcionante o tejido residual normal después de la terapia. Además, la prueba de captación tiroidea de radioyodo (RAIU) cuantifica el metabolismo global del iodo dentro de la glándula tiroides como lo refleja la acumulación del radiofármaco y su cinética en la glándula [2].
Existen, además de los radiofármacos dirigidos al NIS, otros radiotrazadores denominados trazadores de proliferación:
EL 99mTc-sestamibi: Se acumula en la mitocondria por un gradiente eléctrico caracterizado por un alto potencial negativo de membrana interna. Las células cancerosas, con su mayor recambio metabólico, se caracterizan por un mayor gradiente eléctrico de la membrana mitocondrial, y por tanto acumulan una mayor cantidad de 99mTc-sestamibi en comparación con las células normales.
18FDG: Debido a su capacidad de detectar las células que conllevan un mayor consumo de glucosa.
Estos trazadores nos proporcionan información sobre el comportamiento biológico de nódulos tiroideos citológicamente indeterminados [2].
PROCEDIMIENTO
La actividad recomendada para cada radiofármaco está basada en los datos de la literatura y en la experiencia actual. Además, los médicos de medicina nuclear en cada país deben respetar los niveles de referencia de diagnóstico (DRL) para radiofármacos y las normas establecidas en las leyes locales [2]. Las actividades administradas a los niños deben ser una fracción de las administradas a los adultos calculadas en relación con el peso corporal de acuerdo con los factores dados por el Grupo de Trabajo de Armonización de Dosificación Pediátrica EANM / SNMMI [5].
La evaluación escintigráfica de la glándula tiroides con radiofármacos dirigidos al NIS y con sestamibi-99mTc, se realiza normalmente con una gammacámara de campo convencional equipada con un colimador de orificio único (PINHOLE) o con un colimador de alta resolución de orificios paralelos para la obtención de imágenes planares [2]. La imagen obtenida refleja la distribución del radiofármaco en el órgano a estudio. Dicha imagen se denomina gammagrafía. Existe, además, la posibilidad de obtener imágenes tomográficas mediante SPECT (tomografía por emisión de fotón único) [6].
La evaluación de los estudios realizados con radiofármacos emisores de positrones (18FDG)
Se realizan mediante PET (tomografía por emisión de positrones). Una vez que el radiofármaco se encuentra en el interior del paciente, los positrones emitidos, tras un recorrido de unos 2-3 mm, son atraídos fuertemente por electrones del medio (e-), que los aniquilan. De la aniquilación de los positrones con los e-, se genera energía en forma de un par de fotones gamma de 511 keV, de la misma dirección y sentidos opuestos, que son detectados por una cámara PET para formar la correspondiente imagen [6].
La combinación de dos tecnologías de imagen se denomina imagen de fusión o imagen híbrida, que permite visualizar la información proporcionada por dos tipos diferentes de imagen en una única exploración. La combinación del PET o el SPECT con el TC (PET-CT y SPECT-CT) proporcionan información tanto anatómica como funcional de los órganos estudiados por lo que se han convertido en técnicas diagnósticas de uso cotidiano [6].
INDICACIONES
Las indicaciones para la realización de la gammagrafía tiroidea han sido revisadas por el American College of Radiology (ACR), la Society for Pediatric Radiology (SPR) y la Sociedad de Medicina Nuclear e Imagen Molecular (SNMMI) [7].
Esta guía pretende ayudar a los especialistas a recomendar, realizar e interpretar los resultados de la gammagrafía tiroidea con radiofármacos dirigidos al NIS y de la prueba de captación de yodo radiactivo en pacientes con diferentes enfermedades de la tiroides. Los estudios realizados correctamente proporcionan información fidedigna sobre las distintas patologías relacionadas con la glándula tiroides. No obstante, los resultados obtenidos deben de correlacionarse con la información clínica, la exploración física del tiroides y el conocimiento de la medicación del paciente. Además, es importante la correlación con otras pruebas de imagen [7].
La gammagrafía tiroidea es útil para evaluar:
•Tamaño y localización de tejido tiroideo.
•La causa de hipertiroidismo subclínico o manifiesto.
•Sospecha de masas focales o de enfermedad tiroidea difusa.
•Evaluación de prueba de laboratorio sugestivo de función tiroidea anormal.
•Función de nódulos tiroideos detectados en un examen clínico o en otras pruebas de imagen.
•Anomalías congénitas del tiroides incluida ectopia.
•Diferenciación de hipertiroidismo de otras formas de tirotoxicosis (por ejemplo, tiroiditis subaguda, tiroiditis crónica y tiroiditis facticia).
La captación tiroidea es útil para:
•Diferenciar hipertiroidismo de otras formas de tirotoxicosis
•Valorar y calcular la dosis de I131 necesaria para pacientes que van a ser tratados por hipertiroidismo.
Las imágenes de cuerpo entero en el carcinoma de tiroides son útiles para determinar la presencia y localización de:
•Tejido residual funcionante o cáncer después de la cirugía tiroidea o después de la terapia ablativa con radioyodo.
•Metástasis de las formas de cáncer de tiroides que tiene avidez por el Iodo.
Las únicas contraindicaciones descritas para estos procedimientos son el embarazo y la lactancia materna.
Además, hay que tener en cuenta que muchos medicamentos interfieren con la acumulación de los radiofármacos dirigidos al NIS en la glándula tiroides (Tabla 1).
Tabla 1: Compuestos que interfieren en la captación de radiofármacos dirigidos al NIS [7].
MEDICACIÓN |
TIEMPO* |
Metimazol |
3-5 días |
Propiltiouracilo |
3-5 días |
Bromuros |
1 semana |
Mercuriales |
1 semana |
Nitratos |
1 semana |
Perdorato |
1 semana |
Salicilatos (grandes dosis) |
1 semana |
Sulfonamidas |
1 semana |
Tiocianato |
1 semana |
Medicamentos para la tos y |
2 semanas |
Vitaminas que cotienen lodo |
2 semanas |
Solución de yodo (Lugol) |
2-3 semanas |
Agentes tópicos que contienen lodo |
2-3 semanas |
Quelpo |
2-3 semanas |
Tri-iodotironina (T3) |
2-3 semanas |
Levotiroxina (T4) |
4-6 semanas |
Extractos de tiroides |
4 semanas |
Cotrastes yodados i v. |
4 -6 semanas |
Materiales de contraste yodados a |
3-6 meses |
Base de aceite |
|
Amiodarona |
3-6 meses |
*Tiempo que los pacientes deben esperar después de suspender la medicación para realizar la gammagrafía.
Se aconseja, por tanto, obtener un historial médico completo del paciente antes de administrar el radiofármaco y, si es necesario, el examen se debe retrasar adecuadamente [7].
PATOLOGÍAS
EVALUACIÓN DEL HIPERTIROIDISMO
En la evaluación y diagnóstico del hipertiroidismo, tanto la gammagrafía tiroidea como los test de captación del radioyodo (RAIU) son capaces de diferenciar entre tirotoxicosis productiva, caracterizada por un aumento de captación del trazador, que puede ser difusa (enfermedad de Graves), focal (nódulos tiroideos funcionantes) o con múltiples áreas mixtas (BMN) (Figura 1); versus procesos que cursan con disminución de la captación como tirotoxicosis destructiva (es decir, tiroiditis aguda y subaguda) (Figura 2), tirotoxicosis facticia y en sobrecarga exógena de iodo. [2].
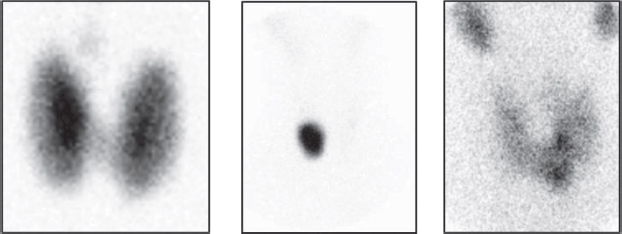
Figura 1. Gammagrafía de tiroides con 99mTcO4 en diferentes causas de hipertiroidismo por tirotoxicosis productiva: A) Bocio difuso hipercaptante por enfermedad de Graves Basedow. Se visualiza el lóbulo piramidal. B) Nódulo autónomo. C) Bocio multinodular con nódulos hiperfuncionantes.

Figura 2. Gammagrafía de tiroides con 99mTcO4 en paciente con hipertiroidismo por tirotoxicosis destructiva: Tiroides bloqueado en paciente con tiroiditis subaguda de Quervain.
EVALUACIÓN DEL HIPOTIROIDISMO CONGÉNITO
El hipotiroidismo congénito (HC) es un trastorno caracterizado por una producción inadecuada de HT y es la causa más común de discapacidad intelectual y trastorno del crecimiento prevenible, por lo que es muy importante el diagnóstico y tratamiento precoz. El cribado neonatal debe realizarse con una actividad multidisciplinar cuya coordinación con el sistema sanitario asistencial resulta imprescindible para asegurar su eficacia y eficiencia. La etiología del hipotiroidismo congénito es multifactorial. Puede ser transitoria (por ejemplo, un exceso de yodo, paso de anticuerpos antitiroideos maternos) o permanente, que necesita tratamiento durante toda la vida. La causa más frecuente de hipotiroidismo permanente es la disgenesia tiroidea y en segundo lugar la agenesia o atireosis. Las dishormonogénesis corresponden a un 10% de los casos [8].
Se ha establecido como screening neonatal del hipotiroidismo congénito, la medida de TSH y de T4 libre o total entre el 2º y 5º días de vida para la detección precoz del HC y para comenzar lo antes posible el tratamiento hormonal sustitutivo [2].
Las pruebas de imagen, gammagrafía y la ecografía tiroideas, son de gran utilidad para revelan la etiología subyacente de CH. La ecografía evalúa la presencia de la glándula tiroides y mide su volumen; sin embargo, es menos sensible que la gammagrafía para diagnosticar la ectopia (Figura 3) y la dishormonogénesis tiroidea [2].
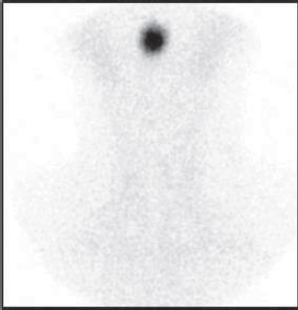
Figura 3. Gammagrafía de tiroides con 99mTcO4 en recién nacido diagnosticado de hipotiroidismo congénito: Tiroides sublingual.
EVALUACIÓN DEL NÓDULO TIROIDEO
La American Thyroid Association (ATA) define el nódulo tiroideo como una lesión discreta dentro de la glándula tiroidea que se diferencia radiológicamente del parénquima tiroideo que la rodea [9].
Los nódulos no palpables detectados en la ecografía u otros estudios de imagen se denominan incidentalomas. Debido al aumento de la utilización de pruebas de imagen y a la alta prevalencia de nódulos tiroideos en la población en general, el hallazgo de estos nódulos se ha convertido en una cuestión importante. Estos nódulos tienen el mismo riesgo de malignidad que los nódulos palpables del mismo tamaño confirmados ecográficamente [9]. Actualmente, la aspiración con aguja fina (FNA) es la prueba práctica más efectiva para determinar si un nódulo es maligno o puede requerir cirugía para llegar a un diagnóstico definitivo. Sin embargo, la mayoría de los nódulos son benignos, e incluso los nódulos malignos, en particular los menores de 1 cm muestran con frecuencia un comportamiento indolente o no agresivo. Por tanto, no todos los nódulos detectados requieren FNA o cirugía [10].
En general, sólo deben evaluarse los nódulos mayores de 1 cm, ya que tienen un mayor potencial de ser cánceres clínicamente significativos. Ocasionalmente, puede haber nódulos menores de 1 cm que requieran evaluación especial debido a síntomas clínicos o a linfoadenopatía asociada. En casos muy raros, algunos nódulos menores de 1 cm carecen de estos signos de advertencia ecográficos y clínicos, pero pueden causar morbilidad y mortalidad en el futuro. Esto es muy poco probable, y dadas las consideraciones desfavorables de costo/beneficio, se considera que propósito de diagnosticar y tratar todos los cánceres de tiroides pequeños causa más daño que beneficio [9].
Se debe realizar una ecografía diagnóstica de tiroides / cuello en todos los pacientes con sospecha de nódulo tiroideo, bocio nodular o anomalía radiográfica que sugiera un nódulo tiroideo detectado de manera incidental en otro estudio de imágenes [9].
La ecografía proporciona una información precisa de las características morfológicas del nódulo, por lo que ha sido utilizada para estandarizar la evaluación del riesgo para malignidad bajo el sistema imagen tiroidea y sistema de informe de datos (ACR-TI-RADS). En este sistema se otorgan puntos por todas las características ecográficas de un nódulo (composición, ecogenicidad, forma, márgenes) y además se otorgan puntos adicionales a las características más sospechosas. El total de puntos obtenidos determina el grado ACR TIRADS del nódulo que varía de TR1 (benigno) a TR5 (alta sospecha de malignidad) (Tabla 2). Las recomendaciones para realizar seguimiento mediante ecografía o realizar FNA van a estar condicionadas por el grado TI-RADS y por el diámetro máximo [10]. Sin embargo, ningún criterio TIRADS es capaz de informar del estado funcional del nódulo.
Tabla 2: Clasificación AC-TI-RADS para el manejo de los nódulos tiroideos. Tessler FN et al. [10].
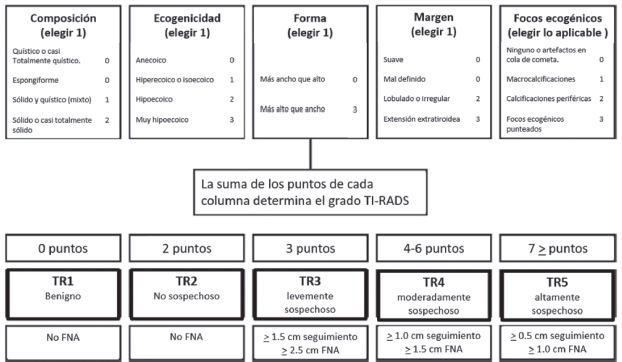
En cambio, los nódulos hiperfuncionantes en gammagrafía tienen un valor predictivo negativo para malignidad de un 96-99%, siendo la gammagrafía tiroidea el único examen capaz de demostrar la presencia de un nódulo tiroideo funcionalmente autónomo (AFNT). Además, mientras un AFNT raramente conlleva malignidad, frecuentemente en estos casos la citología es indeterminada. Por tanto, la integración de la gammagrafía tiroidea en el modelo TI-RADS es esencial para prevenir FNA innecesarias para nódulos que demuestran autonomía [11].
No obstante, la relación entre la autonomía tiroidea y los valores de TSH están condicionados por las variaciones regionales en los niveles de iodo. Por tanto, las diferentes guías clínicas dan indicaciones variables para la realización de la gammagrafía tiroidea (Tabla 3) [2].
Tabla 3. Indicaciones para la evaluación de los nódulos tiroideos mediante gammagrafía en diferentes guías clínicas. Giovanella L. et al. [2].
ATA 2015 |
Germán Endocrine Surgeons 2011 |
AACE/AME/ETA 2010 Y 2016 |
Nódulos > 10-15 mm |
Nódulos > 10 mm |
TSH< límite más bajo de referencia |
TSH disminuida |
Cualquier TSH |
Deficiencia de lodo: TSH< 1.0-1.5 mUI/L |
La mayoría de los cánceres de tiroides son nódulos hipofuncionantes y por tanto en la gammagrafía se comportan como nódulos fríos (Figura 4). Sin embargo, entre el 80-90% de los nódulos fríos vistos en gammagrafía son benignos, por lo que la gammagrafía tiene un bajo grado de especificidad para el diagnóstico de malignidad. La evaluación de estos nódulos está indicada hacerla mediante ecografía de acuerdo con los criterios TI-RADS y su recomendación para realizar FNA [2].
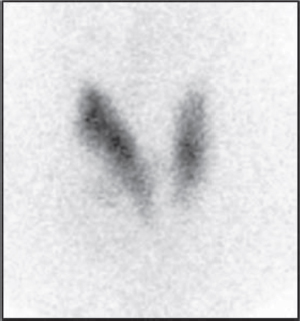
Figura 4. Gammagrafía de tiroides con 99mTcO4 en paciente con nódulo frío en lóbulo tiroideo derecho.
Se ha establecido un sistema de información estandarizado para la biopsia por aspiración de aguja fina (FNA), el sistema Bethesda, que informa la citopatología de nódulos tiroideos y predice el riesgo asociado de malignidad según las características citológicas (Tabla 4) [12]. Este sistema de clasificación ha sido respaldado por la American Thyroid Association [9]. Sin embargo, existen dos categorías en las que el resultado citológico es indeterminado: La clase III que se trata de lesiones foliculares de significado indeterminado o atipia de significado indeterminado (FLUS/AUS) y la neoplasia folicular (Bethesda clase IV), en los que el riesgo de malignidad varía entre el 10 al 30% en la clase III y entre 25-40% en la clase IV, se plantea que actitud seguir. Es prudente realizar primero una gammagrafía tiroidea (si no se obtuvo previamente), particularmente si la TSH se encuentra en el extremo inferior del rango normal [2].
Tabla 4. Sistema Bethesda para el informe de citopatología tiroidea (2017) y predicción de riesgo de malignidad. Cibas ES et al. [12].
Clase |
Categoría diagnóstica |
Riesgo de Malignidad |
I |
No diagnóstico (o insatisfactorio) |
5–10% |
II |
Benigno |
0–3% |
III |
Atipia de significado indeterminado (AUS) o lesión folicular de significado indeterminado (FLUS) |
10–30% |
IV |
Neoplasia folicular (o sospecha de neoplasia folicular) |
25–40% |
V |
Sospechoso para malignidad |
50–75% |
VI |
Malignidad |
97–99% |
Existen varios estudios que han investigado el rendimiento de la gammagrafía de tiroides con 99Tc-MIBI para evaluar nódulos tiroideos sospechosos de malignidad con resultados indeterminados. Treglia G. et al. [13] realizaron un metaanálisis realizando una búsqueda exahustiva de los datos publicados sobre este tema hasta diciembre de 2012. Además, en otro estudio,estos mismos autores (14) valoraron la prevalencia y el riesgo de malignidad de la captación incidental focal tiroidea (FTI) detectada mediante tomografía por emisión de positrones con flúor-18-fluorodesoxiglucosa (18F-FDG). Estos estudios concluyen que Las imágenes moleculares de la glándula tiroides con 99m Tc-sestamibi y 18 FDG permiten evaluar el comportamiento biológico y la agresividad de los nódulos tiroideos hipofuncionantes. En el caso de los nódulos 99m Tc-sestamibiavid y / o 18 FDG-avid, el riesgo de malignidad es de aproximadamente el 35%. Al mismo tiempo, un nódulo caracterizado por una absorción baja o ausente de 99m Tc-sestamibi y / o 18 FDG se considera con un riesgo muy bajo de malignidad. De hecho, el alto VPN de las imágenes de tiroides con 99m Tc-sestamibi u 8FDG es muy útil para caracterizar nódulos con resultados citológicos indeterminados, pero también para nódulos con resultados de FNA repetidamente insuficientes y no diagnósticos. Otras indicaciones para la realización de gammagrafía de tiroides con 99m Tc-sestamibi y / o 18 FDG incluyen la identificación de un nódulo con mayor riesgo de malignidad en pacientes afectados por bocio multinodular grande, o con múltiples nódulos con características sospechosas pro ecografía para la evaluación con biopsia por aspiración de aguja fina (FNA) [2].
CONCLUSIONES
Debido a que el yodo juega un papel importante en la fisiología y la fisiopatología de la glándula tiroidea, el yodo y los análogos del iodo (radiofármacos dirigidos al NIS) resultan muy útiles para la realización de imágenes tiroideas, así como para valorar la captación de iodo por esta glándula.
Los sistemas de clasificación ACR-TIRADS según las características ecográficas de los nódulos tiroideos orientan hacia la necesidad de realizar o no biopsia por aspiración de aguja fina. Sin embargo, no informan del estado funcional del nódulo.
La gammagrafía de tiroides es la única técnica que informa del estado funcional de la glándula. Puesto que la mayoría de los nódulos tiroideos hiperfuncionantes son benignos, es importante su integración en los grupos TIRADS para evitar biopsias innecesarias.
Además, el uso de radiofármacos específicos como son el sestamibi-99mTc y la tomografía por emisión de positrones con 18F-FDG, proporcionan una información útil en el caso de nódulos citológicamente indeterminados. Estos trazadores permiten la evaluación del comportamiento biológico y la agresividad de los nódulos hipofuncionantes. Su alto valor predictivo negativo es de gran ayuda.
Este trabajo, está basado en recomendaciones realizadas por la Sociedad Europea de Medicina Nuclear (EAMN) y la Sociedad de Medicina Nuclear e Imagen Molecular (SNMMI). Su propósito es ayudar a los distintos especialistas (tanto de imagen como a los clínicos) a recomendar, realizar e interpretar la gammagrafía tiroidea con diversos radiofármacos. No obstante, el juicio final sobre cualquier procedimiento o curso de acción específico debe ser realizado por el médico en función de todas las circunstancias que rodeen al paciente.
BIBLIOGRAFÍA
1. Guyton y Hall. Endocrinología y reproducción: Hormonas metabólicas tiroideas. En: John E. Hall. Guyton y Hall Tratado de Fisiología Médica. 12ª edición. S.A. Elsevier España. 2011, pp. 907-19.
2. Giovanella L, Avram AM, Iakovou I, Kwak J, Lawson SA, Lulaj E, et al EANM practice guideline/SNMMI procedure standard for RAIU and thyroid scintigraphy. Eur J Nucl Med Mol Imaging. 2019;46:2514-25.
3. Talavera Rubio MP, Pena Pardo FJ, Jiménez Londoño GA, Poblete García VM, Bellon Guardia ME, Tello Galan MJ, Noriega Álvarez E, García Vicente AM SoCA. M. Medicina Nuclear en la patología tiroidea benigna. En: Soriano A, Martín-Comin J GA. Tratado de Medicina Nuclear en la Práctica Clínica. 3a Edición. Madrid.Aula Médica. 2019, pp. 183–202.
4. Castell M. Síntesis Histórica de la Medicina Nuclear. En: Historia de la Medicina Nuclear en España. Sus primeros cuarenta años. CETIR CENTRE MEDIC: Barcelona. 1993, pp. 7-17.
5. Gelfand MJ, Clements C MJ. Nuclear medicine procedures in chlindren: special considerationes. Semin Nucl Med. 2017;47.110–7.
6. García-Talavera P, Diaz González LG, Martín Gómez E, Peñaherrera Cepeda AC, López Puche S, Tamayo Alonso P. Medicina Nuclear. Diagnóstico de la patología de tiroides y paratiroides. ORL [Internet]. 28 de septiembre de 2019 [citado 18 de sep 2020];11(3):13p. Disponible en: https://revistas.usal.es/index.php/2444-7986/article/view/21496.
7. ACR–SNMMI–SPR practice parameter for the perfomance of scintigraphy and uptake measurements for benign and malignanat Thyroid disease [internet]. [Citado el 21/12/2020]. Disponible en https://www.acr.org/media/ACR/Files/Practice-.
8. Rodríguez Sánchez A, Chueca Guindulain MJ, Alija Merillas M, Ares Segura S, Moreno Navarro JC y Rodríguez Arnao MD, en representación del Grupo de Trabajo De Tiroides de la Sociedad Española de Endocrinología Pediátrica (SEEP). Diagnóstico y seguimiento De los pacientes con hipotiroidismo congénito diagnosticados por cribado neonatal. An Pediatr (Barc). 2019;90(4); 250e1-250e8.
9. Haugen BR, Alexander EK, Bible KC, Doherty GM, Mandel SJ, Nikiforov YE, et al 2015 American Thyroid Association Management Guidelines for Adult Patients with Thyroid Nodules and Differentiated Thyroid Cancer: The American Thyroid Association Guidelines Task Force on Thyroid Nodules and Differentiated Thyroid Cancer. Thyroid. 2016; 26(1):1-133.
10. Tessler FN, Middleton WD, Grant EG, Hoang JK. Et al: ACR Thyroid Imaging, Reporting and Data System (TI-RADS): White Paper of the ACR TI-RADS Committee. Vol. 14(5), Jam Coll Radiol. 2017;14(5):587–95.
11. Noto B, Eveslage M, Pixberg M, Gonzalez Carvalho JM, Schäfers M, Riemann B, et al Prevalence of hyperfunctioning thyroid nodules among those in need of fine needle aspiration cytology according to ATA 2015, EU-TIRADS, and ACR-TIRADS. Eur J Nucl Med Mol Imaging. 2020;47(6):1518–26.
12. Cibas ES, Ali SZ. The 2017 Bethesda system for reporting thyroid cytopathology. Thyroid. 2017;27 (11):1341-6.
13. Treglia G, Caldarella C, Saggiorato E, Ceriani L, Orlandi F, Salvatori M, et al Diagnostic performance of 99mTc-MIBI scan in predicting the malignancy of thyroid nodules: A meta-analysis. Endocrine. 2013 Aug; 44(1):70–8.
14. Treglia G, Bertagna F, Sadeghi R, Verburg FA, Ceriani L GiL. Focal thyroid incidental uptake detected by 18F-fluorodeoxyglucose positron emission tomography. Nuclearmedizin. 2013; 52(04):130–6.